Conceptul de hibridizare este definit ca procesul de combinare a doi orbitali atomici pentru a crea un nou tip de orbitali hibridizați. Această amestecare duce de obicei la formarea de orbitali hibrizi cu energii, forme complet diferite și așa mai departe. Hibridizarea este realizată în principal de orbitali atomici de același nivel de energie. Cu toate acestea, atât orbitalii complet umpluți, cât și pe jumătate umpluți pot participa la acest proces dacă energiile lor sunt egale. Conceptul de hibridizare este o extensie a teoriei legăturilor de valență care ne ajută să înțelegem formarea legăturilor, energiile legăturilor și lungimile legăturilor.
Ce este hibridizarea?
Când doi orbitali atomici se combină pentru a forma un orbital hibrid într-o moleculă, energia orbitalilor atomilor individuali este redistribuită pentru a da orbitali cu energie echivalentă. Aceasta este cunoscută sub numele de hibridizare.
Orbitalii atomici de energii comparabile sunt amestecați împreună în timpul procesului de hibridizare, care implică în principal fuziunea a doi orbitali sau a doi orbitali „p” sau amestecarea unui orbital „s” cu un orbital „p”, precum și cu un „s”. orbital cu un orbital „d”.
șir subșir java
Orbitali hibrizi sunt noii orbitali formați în urma acestui proces. Mai important, orbitalii hibrizi pot fi folosiți pentru a explica proprietățile legăturilor atomice și geometria moleculară. Carbonul, de exemplu, formează patru legături simple în care orbitalul s a învelișului de valență se combină cu trei orbitali p a învelișului de valență. Această combinație generează patru sp echivalente3amestecuri. Acestea vor fi aranjate într-un model tetraedric în jurul carbonului, care este legat de patru atomi diferiți.
Pași pentru a determina tipul de hibridizare
Pentru a înțelege tipul de hibridizare într-un atom sau un ion, trebuie respectate următoarele reguli.
- Mai întâi, determinați numărul total de electroni de valență conținuti într-un atom sau ion.
- Apoi, numărați numărul de perechi singure atașate la acel atom sau ion.
- Acum, numărul de orbitali necesari poate fi calculat prin adăugarea numărului de duplex sau octet și a numărului de perechi singure de electroni.
- Trebuie remarcat faptul că geometria orbitalilor în atomi sau ioni este diferită atunci când nu există o pereche de electroni singură.
Caracteristicile hibridizării
- Hibridizarea are loc între orbitalii atomici cu energii egale.
- Numărul de orbitali hibrizi formați este egal cu numărul de orbitali atomici care se amestecă.
- Nu este necesar ca toți orbitalii pe jumătate umpluți să participe la hibridizare. Pot participa chiar și orbitalii care sunt complet umpluți, dar au energie ușor variabilă.
- Hibridizarea are loc numai în timpul formării legăturilor, nu într-un singur atom de gaz.
- Dacă hibridizarea moleculei este cunoscută, forma moleculei poate fi prezisă.
- Lobul mai mare al orbitalului hibrid este întotdeauna pozitiv, în timp ce lobul mai mic de pe partea opusă este întotdeauna negativ.
Tipuri de hibridizare
Hibridizarea poate fi clasificată ca sp3, sp2, sp., sp3d, sp3d2, sau sp3d3pe baza tipurilor de orbitali implicați în amestecare.
sp Hibridarea
Apare atunci când un orbital s și unul p din învelișul principal al unui atom se combină pentru a forma doi orbitali echivalenti noi. Orbitalii nou formați sunt cunoscuți ca orbitali hibridizați sp. Produce molecule liniare la un unghi de 180°. Aceasta presupune combinarea unui orbital și a unui orbital „p” de energie egală pentru a produce un nou orbital hibrid cunoscut sub numele de orbital hibridizat sp.
- Este cunoscută și sub numele de hibridizare diagonală.
- Fiecare orbital hibridizat sp conține aceeași cantitate de caractere s și p.
- Toți compușii de beriliu, cum ar fi BeF2, Bine2, și BeCl2, sunt exemple.

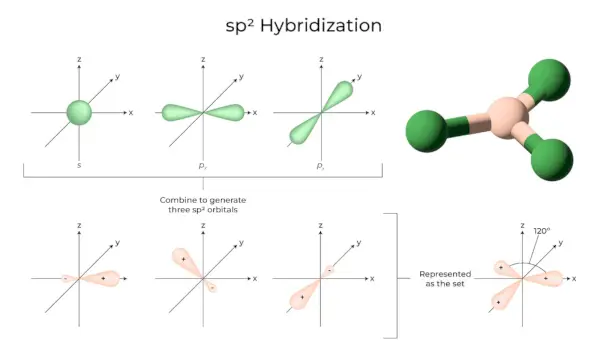
sp2Hibridizare
Apare atunci când unul s și doi orbitali p ai aceluiași înveliș atom se combină pentru a forma trei orbitali echivalenti. Orbitalii nou formați sunt cunoscuți ca sp2orbitali hibrizi. Este cunoscută și sub numele de hibridizare trigonală. Aceasta presupune combinarea unui orbital cu doi orbitali „p” de energie egală pentru a crea un nou orbital hibrid cunoscut sub numele de sp.2. Un amestec de simetrie trigonală de orbitali s și p este menținut la 120 de grade. Toți cei trei orbitali hibrizi rămân în același plan și formează un unghi de 120° unul cu celălalt.
conversia șir în int java
- Fiecare orbital hibrid format are un caracter „p” de 33,33 % și 66,66 %.
- Moleculele cu formă plană triunghiulară au un atom central care este legat de alți trei atomi și este sp2hibridizat. Compușii de bor sunt exemple.
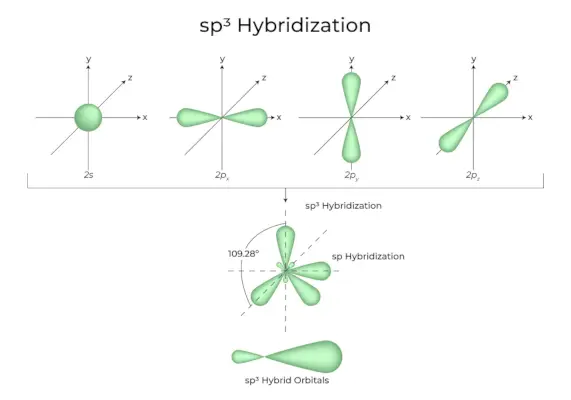
sp3Hibridizare
Când un orbital „s” și trei orbitali „p” din aceeași înveliș a unui atom se combină pentru a forma patru orbitali echivalenti noi, hibridizarea este cunoscută ca hibridizare tetraedrică sau sp.3. Orbitalii nou formați sunt cunoscuți ca sp3orbitali hibrizi. Acestea sunt îndreptate spre cele patru colțuri ale unui tetraedru obișnuit și formează un unghi de 109°28′ între ele.
- Sp3orbitalii hibrizi formează un unghi de 109,28 grade.
- Fiecare orbital hibrid are un caracter s de 25% și un caracter p de 75%.
- Etanul și metanul sunt două exemple.
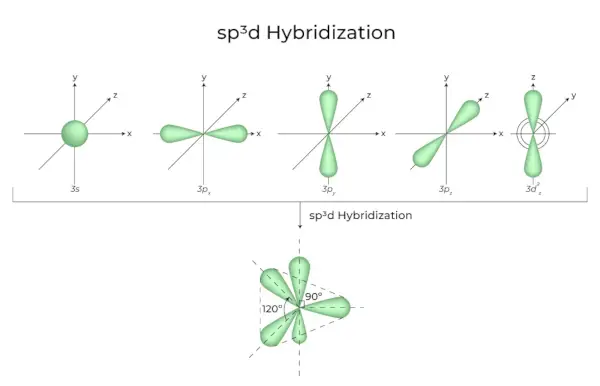
sp3d Hibridarea
Amestecarea orbitalilor 1s, orbitalilor 3p și orbitalilor 1d are ca rezultat 5 orbitali hibridizați sp3d de energie egală. Geometria lor este trigonală bipiramidală. Combinația de orbitali s, p și d are ca rezultat o simetrie bipiramidală trigonală. Orbitalii ecuatoriali sunt trei orbitali hibrizi care sunt orientați la un unghi de 120° unul față de celălalt și se află în plan orizontal.
- Cei doi orbitali rămași, cunoscuți ca orbitali axiali, se află în planul vertical la 90 de grade al orbitalilor ecuatoriali.
- Hibridizarea în pentaclorură de fosfor, de exemplu (PCl5).
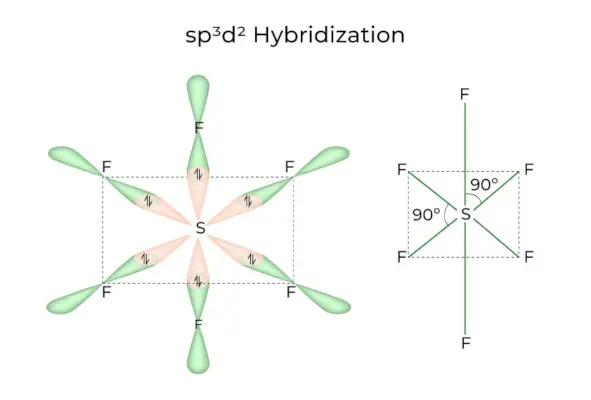
sp3d2 Hibridizare
Când orbitalii 1s, 3p și 2d se combină pentru a forma 6 sp identice3d2orbitali hibrizi, hibridizarea se numește sp3d2Hibridizare. Acești șapte orbitali indică colțurile unui octaedru. Sunt înclinate la un unghi de 90 de grade unul față de celălalt.
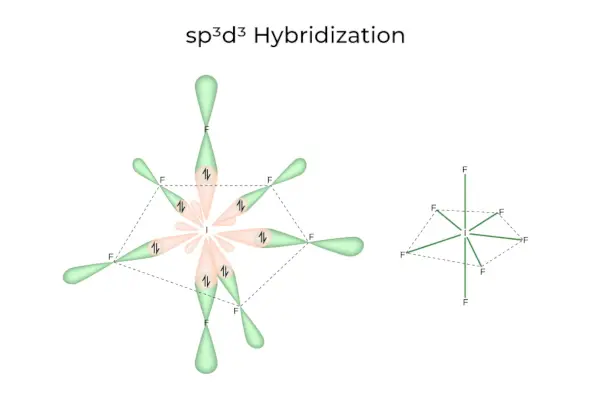
sp3d3Hibridizare
Are orbitali 1s, 3p și 3d, care se combină pentru a forma 7 sp identice3d3orbitali hibrizi. Acești șapte orbitali indică colțurile unei bipiramidale pentagonale. de exemplu. DACĂ6.
Forme de hibridizare
- Linear: Hibridizarea sp este cauzată de interacțiunea grupurilor cu doi electroni; unghiul orbital este de 180°. Plan trigonal: sunt implicate trei grupuri de electroni, rezultând sp2hibridizare; orbitalii sunt la 120° unul de altul. Tetraedric: sunt implicate patru grupuri de electroni, rezultând sp3hibridizare; unghiul orbital este de 109,5°. Trigonal bipiramidal: sunt implicate cinci grupuri de electroni, rezultând sp3d hibridizare; unghiurile orbitale sunt de 90° și 120°. Octaedral: sunt implicate șase grupuri de electroni, rezultând sp3d2hibridizare; orbitalii sunt distanțați de 90°.
Întrebări frecvente pe Hibridizare
Întrebarea 1: Dintre sp, sp2 și sp3, care orbital hibrid este mai electronegativ?
Răspuns:
Procentul caracterului s în sp, sp2, și sp3carbonul hibridizat este de 50%, 33,33% și, respectiv, 25%. Datorită formei sferice a orbitalului s, acesta este atras uniform din toate direcțiile de nucleu. Ca rezultat, un orbital hibrid cu caracter s va fi mai aproape de nucleu și, prin urmare, mai electronegativ. Ca rezultat, carbonul hibridizat sp este cel mai electronegativ.
sfoară în c
Întrebarea 2: Ce sunt orbitalii hibrizi?
Răspuns:
Orbitii hibrizi sunt formați prin combinarea orbitalilor atomici standard și rezultând în formarea de noi orbitali atomici.
Întrebarea 3: Care sunt cele cinci forme de hibridizare?
Răspuns:
Linear, trigonal planar, tetraedric, trigonal bipiramidal și octaedric sunt cele cinci forme de bază ale hibridizării.
Întrebarea 4: De ce molecula de amidă arată ca sp3hibridizat dar este sp2?
Răspuns:
depozitul maven
Dacă atomul este fie închis de doi sau mai mulți orbitali p, fie are o pereche singură capabilă să sară într-un orbital p, procesul general de hibridizare se va schimba. Ca urmare, în cazul unei molecule de amidă, perechea singură intră într-un orbital p, rezultând trei orbitali p paraleli adiacenți.
Întrebarea 5: Care este regula lui Bent?
Răspuns:
Un atom central conectat la numeroase grupe dintr-o moleculă se va hibridiza, determinând ca orbitalii cu mai mult caracter s să fie direcționați către grupuri electropozitive și orbitalii cu mai mult caracter p să fie direcționați către grupări electronegative.
