Baza este un compus chimic care constă din OH–ioni și acceptă protoni. Baza în chimie sunt acei compuși care devin roșu turnesol albastru și când reacționează cu acidul neutralizează reacția pentru a da sare și apă. Valoarea pH-ului bazei este mai mare de 7. Bazele au gust amar și alunecoase la atingere. Bazele care sunt solubile în apă se numesc alcaline. Exemple de baze sunt oxizii de metal, hidroxidii de metal, etc. Săpunul este un exemplu de bază pe care o folosim în viața de zi cu zi. În acest articol, vom afla în detaliu despre definiția, proprietățile și reacțiile chimice ale bazelor.

Definiția de bază
Baza este definită ca compusul chimic a cărui valoare pH este mai mare de 7, acceptă un proton, neutralizează acidul și transformă turnesolul roșu în albastru. În general, ei eliberează OH–ion la disociere. Exemplele includ NaOH, NaHCO3,etc. Următoarele sunt câteva caracteristici generale prezentate de bază:
- Au un gust amar
- Sunt alunecoase la atingere
- Devin albastru turnesol roșu
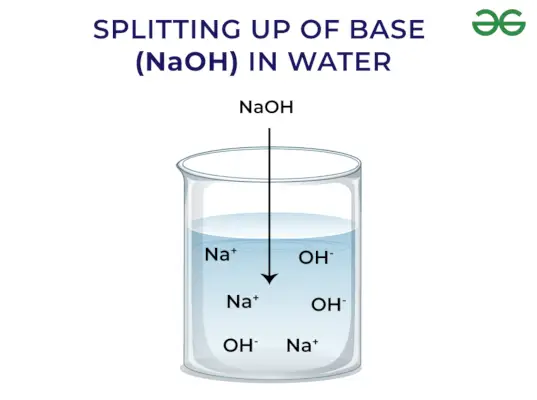
- Ei eliberează OH–ion când este dizolvat în apă
- Ei conduc electricitatea sub formă de soluție
Bazele sunt unul dintre cei mai importanți compuși chimici care sunt utilizați în viața de zi cu zi. Bazele sunt folosite ca antiacid pentru a controla aciditatea si in pasta de dinti pentru a neutraliza actiunea bacteriana care produce acid in gura noastra si previne degradarea smaltului si a cariilor. Ele sunt, de asemenea, folosite ca praf de copt, bicarbonat de sodiu și praf de spălat.
Baza Lewis
Bazele Lewis sunt compușii care au perechi de electroni și o pot dona compușilor care au deficit de perechi de electroni. Bazele Lewis sunt de natură nucleofilă, adică sunt iubitoare de nuclee, ceea ce înseamnă că vor ataca un centru încărcat pozitiv cu perechile lor de electroni. Exemple de bază Lewis includ amoniacul deoarece în amoniac (NH3) atomul central Azotul are 5 electroni din care 3 sunt folosiți pentru a face legături cu 3 atomi de hidrogen și o pereche de electroni rămâne cu atomul de azot formând astfel NH3o bază Lewis.
Baza Arrhenius
Conform conceptului lui Arrhenius, bazele sunt compuși care eliberează ioni de hidroxid atunci când sunt dizolvați în apă și cresc concentrația ionilor de hidroxil în soluția apoasă. De exemplu, atunci când KOH este dizolvat în apă, va da OH–ion și astfel crește concentrația de OH–in apa.
Baza Bronsted
Conceptul Bronsted de bază este o versiune avansată a conceptului lui Arrhenius care afirmă că bazele sunt compuși care acceptă H+ion sau proton pentru a forma acidul lor conjugat. De exemplu Cl–este o bază care acceptă H+pentru a forma HCl ca acid conjugat.
lup sau vulpe
Tipuri de baze
Bazele pot fi clasificate pe baza acidității, concentrației și capacității de ionizare. Clasificarea este menționată mai jos
Tipuri de baze bazate pe aciditate
Aciditatea unei baze se referă la numărul de grupări hidroxil înlocuibile prezente într-o moleculă a bazei. În funcție de aciditate, bazele sunt clasificate în trei categorii:
- Baza monoacida
- Baza diacidica
- Baza triacidă
Monoacid: Bazele monoacide sunt cele care conțin un singur ion hidroxil înlocuibil și interacționează cu un singur ion de hidrogen. Bazele monoacide includ NaOH, KOH și altele.
Diacid: Baza diacidă este o bază cu doi ioni hidroxil înlocuibili care interacționează cu doi ioni de hidrogen. Ca(OH)2, Mg(OH)2, și alte baze di-acide sunt exemple.
triacid: Baza triacidă este un tip de bază care cuprinde trei ioni hidroxil înlocuibili și trei ioni de hidrogen. Bazele triacide includ Al(OH)3, Fe(OH)3, si altii.
Tipuri de baze pe baza concentrației lor în soluție apoasă
Concentrația se referă la cantitatea de bază prezentă într-o soluție apoasă. Pe baza concentrației lor în soluție apoasă, bazele sunt împărțite în două categorii:
- Baza concentrata
- Baza diluata
Baza concentrata: Bazele concentrate sunt cele în care cantitatea de bază este mare în comparație cu solventul. Soluție concentrată de NaOH, de exemplu.
Baza diluata: Aceste tipuri de baze au o concentrație mai mică de bază în soluția lor apoasă. Diluarea este procesul de reducere a procentului de substanță dizolvată prin adăugarea unei cantități mai mari de solvent. De exemplu, diluați NaOH, diluați KOH și așa mai departe.
Tipuri de baze bazate pe gradul de ionizare
Gradul de ionizare se referă la capacitatea unui compus chimic de a elibera ionul lor constitutiv atunci când este dizolvat în apă. În cazul bazei, gradul de ionizare se referă la capacitatea bazei de a elibera OH–ionii atunci când sunt dizolvați în apă. În funcție de gradul de ionizare, bazele sunt clasificate în două tipuri:
- Baza puternica
- Baza slaba
Baza puternica: Bazele tari sunt acele baze care se disociază complet și eliberează ion OH- atunci când sunt dizolvate în apă. Câteva exemple de baze puternice includ NaOH, KOH etc.
Baza slaba: Bazele care nu suferă o disociere completă și eliberează doar o fracțiune de ion OH- se numesc bază slabă. Exemple de baze slabe includ Al(OH)3,Cu(OH)2,etc.
Află mai multe, Baze puternice și slabe
Proprietățile bazelor
Deoarece știm că bazele sunt compuși chimici care au ion OH-, devin roșu turnesol albastru etc. În această secțiune, vom afla despre proprietățile fizice și chimice ale bazelor împreună cu câteva cunoștințe scurte despre proprietățile lor generale.
Proprietățile generale ale bazei
Proprietățile generale ale bazelor sunt menționate mai jos:
- Un ion hidroxid (OH–) este eliberat în apă de baze. Cu cât baza devine mai puternică pe măsură ce sunt eliberați mai mulți ioni.
- Bazele reacţionează cu acidul pentru a forma sare Acizii reacţionează cu bazele. Această reacție a unei baze cu acid se numește reacție de neutralizare.
- Bazele devin turnesol roșu în albastru.
- Structura unei proteine poate fi modificată de baze. Bazele au această calitate, ceea ce le face să se simtă slick. Săpunul este o bază care devine incredibil de alunecoasă pe pielea ta când este umedă. Datorită capacității lor de a modifica structura proteinelor, unele baze puternice sunt extrem de periculoase.
Proprietățile fizice ale bazelor
Bazele au gust amar: Bazele au gust amar. Datorită amărăciunii sale, avem doar câteva alimente alcaline. Există doar câteva materiale alimentare alcaline. Bazele trebuie gustate cu mai multă precauție în comparație cu acizii.
Bazele sunt alunecoase la atingere: Când sunt atinse, bazele se simt alunecoase. De exemplu săpun.
java arenext
Bazele eliberează OH – Ion: Când bazele sunt dizolvate în apă, ei eliberează ion hidroxil (OH–). În funcție de capacitatea de a elibera ioni de hidroxil, aceștia sunt clasificați ca puternici și slabi.
Bazele neutralizează acizii: Cand bazele reactioneaza cu acizii, se neutralizeaza reciproc si produc sare si apa. Această reacție se numește Reacția de neutralizare . Să presupunem că avem acidul HY și baza „XOH”, apoi sarea formată va fi „XY”. Ecuația pentru această reacție poate fi dată ca HY + XOH → HOH + XY.
Bazele proteinelor denaturate: Denaturarea proteinei înseamnă distrugerea stabilității și structurii proteinei. Acest lucru face utilizarea bazelor dăunătoare pentru oameni, deoarece pielea și părul uman sunt alcătuite din proteine, iar atunci când alcalii puternici, cum ar fi hidroxidul de sodiu sau potasiu, numite și leșie, creează un impact dăunător asupra pielii umane.
Bazele transformă turnesolul roșu în albastru: Când bazele sunt aduse în contact cu turnesolul roșu, acesta îl devin albastru. Cu toate acestea, trebuie menționat că nu se poate observa o astfel de schimbare atunci când încercăm să reacționăm baza uscată cu hârtie de turnesol roșie. Testul de hârtie de turnesol este una dintre cele mai vechi metode de testare a bazei. Cu toate acestea, există și alți indicatori, cum ar fi fenolftaleina
Bazele conduc electricitatea: Când bazele sunt sub formă de soluție, au ion OH- mobili, deci pot conduce electricitatea.
Proprietățile chimice ale bazelor
- Reacția bazei cu metalele: Când alcalii (baza) reacţionează cu metalul, se produce sarea şi hidrogenul gazos.
Alcali + Metal → Sare + Hidrogen
Exemple:
- Când hidroxidul de sodiu interacționează cu metalul aluminiu, se generează aluminat de sodiu și hidrogen gazos.
2 NaOH + 2 Al + 2 H 2 O → 2 NaAlO 2 + 2 H 2
- Când hidroxidul de sodiu interacționează cu metalul zinc, produce hidrogen gazos și zincat de sodiu.
2 NaOH + Zn → Na 2 ZnO 2 + H 2
- Reacția oxizilor nemetalici cu baza: Sarea și apa se formează atunci când oxizii nemetalici reacționează cu o bază.
Oxid nemetalic + bază → sare + apă
Când hidroxidul de calciu, o bază reacţionează cu dioxid de carbon, apoi se produce carbonat de calciu şi apă.
Ca(OH) 2 + CO 2 → CaCO 3 + H 2 O
- Reacția alcalinelor/bazei cu sărurile de amoniu: Amoniacul este produs atunci când alcalii reacţionează cu sărurile de amoniu.
Alcali + sare de amoniu → sare + apă + amoniac
Când hidroxidul de calciu reacţionează cu clorura de amoniu, se formează apă cu clorură de calciu şi amoniac.
Ca(OH) 2 + NH 4 Cl → CaCl 2 + H 2 O + NH 3
controlul programului stocat
Exemple de baze
Bazele sunt, în general, oxid metalic, hidroxid metalic, carbonat hidrogen metalic, carbonați metalici etc. Să vedem câteva dintre exemplele de baze cu aplicarea lor sub formă tabelară:
| Bazele | Aplicații |
|---|---|
| Hidroxid de potasiu KOH | Folosit în bateriile alcaline |
| Hidroxid de sodiu NaOH | Folosit la fabricarea săpunului și a detergentului |
| Hidroxid de magneziu Mg(OH) 2 | Folosit ca antiacide |
| Bicarbonat de sodiu NaHCO 3 | Folosit ca bicarbonat de sodiu dimensiunea vectorului c++ |
| Bicarbonat de sodiu Deja 2 CO 3 | Folosit ca sifon pentru spălat |
| Amoniac NH 3 | Folosit la fabricarea produselor de curățenie și farmaceutice |
| Hidroxid de calciu Ca(OH) 2 | Folosit la spălarea albă |
Utilizări ale bazelor
Există diverse cazuri de utilizare a bazei, unele dintre acestea sunt:
- Hidroxidul de sodiu este folosit la fabricarea săpunului și hârtiei. Hidroxidul de sodiu (NaOH) este, de asemenea, utilizat în producția de raion.
- Pudra de albire este fabricată din Ca(OH)2, cunoscut sub numele de var stins sau hidroxid de calciu.
- Hidroxidul de calciu este folosit pentru a crea amestecuri uscate pentru vopsire și decorare.
- Hidroxidul de magneziu, cunoscut sub numele de lapte de magnezie, este un laxativ care este utilizat pe scară largă. De asemenea, este folosit ca antiacid deoarece scade excesul de aciditate din stomacul uman.
- În laboratoare, hidroxidul de amoniu este un reactiv critic.
- Varul stins poate fi folosit pentru a neutraliza orice exces de aciditate din sol.
Citeşte mai mult
- Acid, bază și sare
- Puterea acidului
- Ionizarea acidului și bazei
Întrebări frecvente despre bazele în chimie
1. Ce sunt bazele?
- Compușii de bază au o aromă amară.
- Textura majorității bazelor este săpunoasă.
- Când este testat pe hârtie de turnesol, transformă hârtia de turnesol roșie în hârtie de turnesol albastră în majoritatea cazurilor.
- În soluție, compușii de bază conduc și ei electricitatea.
- Când compușii de bază sunt dizolvați în apă, ionii OH- sunt eliberați.
2. Care sunt funcțiile bazelor?
Acasă, folosim baze ca agenți de curățare și antiacide. Săpunurile, leșia (care este folosită în curățarea cuptorului), laptele cu magnezie și Tums sunt toate exemple de baze populare de casă. Fiecare dintre ele are un pH mai mare de șapte, poate consuma hidrogen liber și poate neutraliza acizii.
3. Care este cea mai importantă distincție între un acid și o bază?
Acizi și baze sunt două tipuri de substanțe chimice corozive. Materialele acide au o valoare a pH-ului între 0 și 7, în timp ce bazele au o valoare a pH-ului între 7 și 14. Acizii sunt substanțe chimice ionice care se descompun în apă pentru a crea ionul de hidrogen (H+), în timp ce baza se disociază pentru a da ion OH-.
4. Care sunt proprietățile fizice ale bazelor?
- Au un gust amar la ei.
- Soluțiile lor apoase au o calitate de săpun pentru ei.
- Ele schimbă culoarea hârtiei de turnesol de la roșu la albastru.
- Soluțiile lor apoase sunt conductoare de electricitate.
- Odată cu eliberarea de hidrogen gazos, bazele reacţionează cu metalele pentru a genera sare.
5. Ce se va întâmpla când hidroxidul de calciu reacţionează cu clorura de amoniu?
Când hidroxidul de calciu reacţionează cu clorura de amoniu, se formează apă cu clorură de calciu şi amoniac.
Ca(OH) 2 + NH 4 Cl → CaCl 2 + H 2 O + NH 3
6. Ce se va întâmpla când hidroxidul de sodiu reacţionează cu metalul zinc?
Când hidroxidul de sodiu interacționează cu metalul zinc, produce hidrogen gazos și zincat de sodiu.
testarea software-ului2 NaOH + Zn → Na 2 ZnO 2 + H 2
7. Ce este Lewis Base?
Bazele Lewis sunt compușii care donează o pereche de electroni compusului cu deficit de electroni. Exemplul include NH3.
8. Din ce sunt făcute bazele?
Bazele constau în general din OH–ion. Pe lângă acești oxizi de metal, carbonați și hidrogen carbonați sunt și baze.
9. Ce sunt alcaline?
Bazele care sunt solubile în apă se numesc alcaline. Un exemplu este hidroxidul de sodiu NaOH.
10. Ce sunt baza puternică și baza slabă?
Bazele care se disociază complet pentru a da OH–ionii la dizolvarea în apă se numesc bază tare. Exemplele includ NaOH. Bazele slabe sunt cele care nu se disociază complet pentru a elibera OH–ionul se numește bază slabă. Exemple de baze slabe includ hidroxidul de amoniu.
