Orbitali atomici , care sunt funcții matematice, descriu comportamentul undelor electronilor (sau perechilor de electroni) într-un atom. Orbitalii atomici au forme diferite în funcție de tipul lor. Diferitele forme ale orbitalilor atomici descriu că există fie cea mai mare sau zero probabilitate de a găsi un electron în jurul nucleului în anumite direcții. Există patru tipuri de orbitali, fiecare cu o formă diferită și reprezentați prin literele s, p, d și f. Orbitalii s și p sunt luați în considerare deoarece sunt cei mai abundenți în chimia chimică și biologică. Un orbital s are un nucleu sferic în centru, a p-orbital are formă de gantere și patru din cinci orbitalii d sunt în formă de trifoi. Al cincilea orbital d este modelat ca o ganteră lungă cu o gogoașă în centru. Orbitii unui atom sunt organizați în straturi sau învelișuri de electroni.
Ce sunt orbitalii atomici?
Orbitalii atomici sunt spațiul tridimensional din apropierea nucleului unui atom unde posibilitatea de a descoperi un electron este maximă.
Un atom, conform modelului atomic cuantic, poate avea un număr infinit de orbitali. Acești orbitali pot fi clasificați în funcție de dimensiunea, forma sau orientarea lor. Un orbital mai îngust înseamnă că există o probabilitate mai mare de a prinde un electron aproape de nucleu. Funcția de undă orbitală este adesea cunoscută ca o funcție matematică care este folosită pentru a exprima coordonatele unui electron. Probabilitatea de a localiza un electron este reprezentată de pătratul funcției de undă orbitală. Această funcție de undă ajută, de asemenea, la crearea diagramelor de suprafață limită.
Funcția de undă orbitală
The model atomic cuantic prezice că un atom poate avea o mare varietate de orbiti. Acești orbitali pot fi grupați în funcție de dimensiunea, geometria sau înclinația lor. O dimensiune orbitală redusă crește probabilitatea de a obține un electron aproape de nucleu. Funcția matematică folosită pentru a reprezenta coordonatele unui electron se numește funcția de undă orbitală . Probabilitatea de a descoperi un electron este reprezentată de pătratul funcției de undă orbitală.
De asemenea, putem folosi această funcție de undă pentru a crea diagrame de suprafață limită. Putem înțelege mai bine forma orbitalilor utilizând diagrame de suprafață limită ale densității constante de probabilitate pentru diferiți orbitali.
funcții în c
Formele orbitalilor atomici
Formele orbitalilor atomici variază. Adică, distribuțiile de probabilitate ale electronilor pe care îi descriu în jurul nucleului sunt diferite. Faptul că electronii din diferiți orbitali sunt probabil localizați în diferite zone din jurul nucleului părinte și, prin urmare, experimentează atracția acestuia din urmă cu forțe variate este unul dintre motivele pentru care orbitalii variază în energie. Este uimitor faptul că toți orbitalii dintr-un anumit înveliș al atomului de hidrogen au aceeași energie, în timp ce au forme variate. Acest lucru se datorează eliminării diferitelor contribuții legate de energie.
Dar de îndată ce există un al doilea electron, degenerarea dispare.
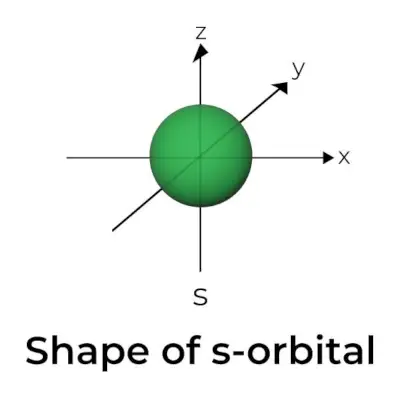
Forma orbitalului s
- Diagrama suprafeței limitei orbitale s seamănă cu o sferă cu nucleul în centru, care poate fi arătată în două dimensiuni ca un cerc.
- S-orbitalii sunt simetrici sferic, ceea ce înseamnă că probabilitatea de a găsi un electron la o anumită distanță este aceeași în toate direcțiile.
- De asemenea, se arată că mărimea orbitalului s crește pe măsură ce crește valoarea numărului cuantic primar (n); prin urmare, 4s> 3s> 2s> 1s.
- Punctul nodal este o locație în care nu există nicio șansă de a localiza electronul. Nodurile sunt clasificate în două tipuri: noduri radiale și noduri unghiulare. Distanța de la nucleu este calculată de nodurile radiale, în timp ce orientarea este determinată de nodurile unghiulare.
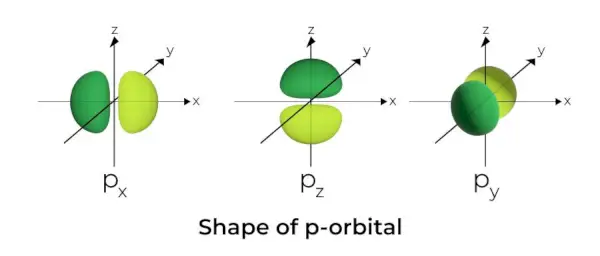
Forma p-orbitalului
- Orbitalii p sunt formați ca niște gantere.
- Nodul orbital p este situat în centrul nucleului.
- Datorită prezenței a trei orbitali, orbitalul p poate ocupa maximum șase electroni.
- Fiecare orbital p este alcătuit din două părți cunoscute sub numele de lobi care sunt situate de fiecare parte a planului care traversează nucleul.
- Fiecare orbital p are părți cunoscute sub numele de lobi de fiecare parte a planului care traversează nucleul. În planul în care cei doi lobi se intersectează, probabilitatea de a găsi un electron este zero.
- Cei trei orbitali sunt cunoscuți ca orbitali degenerați deoarece au aceeași dimensiune, formă și energie.
- Singura diferență dintre orbitali este orientarea lobilor. Deoarece lobii sunt orientați de-a lungul axei x, y sau z, li se dau numele 2px, 2py, și 2pz. Formula n –2 este folosită pentru a calcula numărul de noduri.
- Similar cu orbitalii s, dimensiunea și energia orbitalilor p cresc pe măsură ce numărul cuantic primar crește (4p> 3p> 2p).
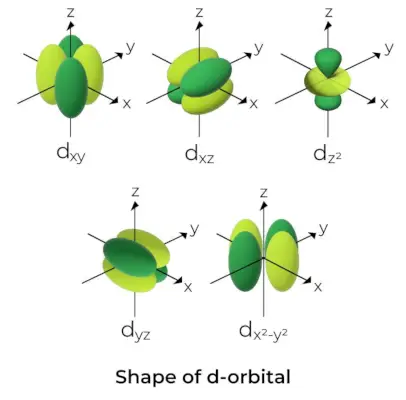
Forma d-orbital
- Pentru orbitalii d, numărul cuantic al orbitalului magnetic este dat ca (-2,-1,0, 1,2). Ca rezultat, putem pretinde că există cinci orbitali d.
- Acești orbitali sunt notați cu simbolurile dX y, dyz, dxz, dX2-și2, și dCu2.
- Formele primilor patru orbitali d sunt similare între ele, ceea ce diferă de dCu2orbital, dar energia tuturor celor cinci orbitali d este aceeași.
Forma f-orbital
- Forma orbitalului f este dispersată. Deoarece valoarea lui l=3 pentru orbitalul f, valoarea minimă a numărului cuantic primar n este 4.
- Valorile ml echivalente pentru orbitalul f sunt (-3,–2, –1, 0, +1, +2, +3).
- Ca rezultat, există șapte orbitali f pentru l = 3.

deschide meniul de setări
Orbitali degenerați
Orbitii degenerați sunt cei cu aceeași energie. Acești orbitali sunt diferiți (pot fi orientați diferit în spațiul din jurul nucleul atomic ), totuși au aceeași energie. În prezența unui câmp extern, degenerarea orbitalului p este neafectată; cu toate acestea, degenerarea orbitalilor f și d poate fi întreruptă prin aplicarea unui câmp extern sistemului (fie câmp electric sau magnetic).
Puțini orbitali vor avea energie mai mare, în timp ce alții vor avea energie mai mică. Degenerarea nu va mai exista în sistem. De exemplu, orbitalii d sunt formați din cinci orbitali degenerați care au toți aceeași energie.
Citeşte mai mult:
- Teoria orbitală moleculară
- Umplerea orbitalului într-un atom
- Hibridizare
Întrebări frecvente despre formele orbitalilor atomici
Întrebarea 1: Cum funcționează orbitalii?
Răspuns:
Un orbital atomic este o expresie matematică care exprimă comportamentul ondulatoriu al unui electron sau al unei perechi de electroni dintr-un atom în teoria atomică și mecanica cuantică. Fiecare orbital va prelua maximum doi electroni, fiecare cu propria sa cantitate de spin.
vikas divyakirti
Întrebarea 2: Ce este Planul Nodal?
Răspuns:
Planul în care probabilitatea de a găsi un electron este neglijabilă sau zero se numește plan nodal.
Întrebarea 3: Câți orbiti sunt?
mașină virtuală java
Răspuns:
Deoarece subnivelul s are doar un orbital, pot fi prezenți doar doi electroni. Deoarece subnivelul p cuprinde trei orbitali, pot fi prezenți maximum șase electroni. Deoarece subnivelul d cuprinde 5 orbitali, pot fi prezenți maximum 10 electroni. Și fiecare dintre cele patru sub-niveluri are șapte orbitali care pot deține maximum 14 electroni.
Întrebarea 4: Care orbitali au cea mai mare energie?
Răspuns:
stivă în java
Orbitul 1 are cea mai mare energie. Energia unui electron este cantitatea de energie necesară pentru a-l scoate din bula electrică a atomului.
Întrebarea 5: Care este diferența dintre o coajă și un orbital?
Răspuns:
Într-un atom, un înveliș este o colecție de subînvelișuri ale aceleiași teorii a numerelor cuantice, n. Orbitalii au fiecare doi electroni, iar electronii din același orbital au aceeași definiție a mărimii, mărimii momentului unghiular și numărului cuantic magnetic.
Întrebarea 6: Ce este legătura sigma și pi?
Răspuns:
Suprapunerea orbitală atomică creează legături sigma și pi. Legăturile Sigma sunt create prin suprapunerea lobilor orbitali atomici, în timp ce legăturile Pi sunt generate atunci când un lob orbital atomic se suprapune pe altul.
