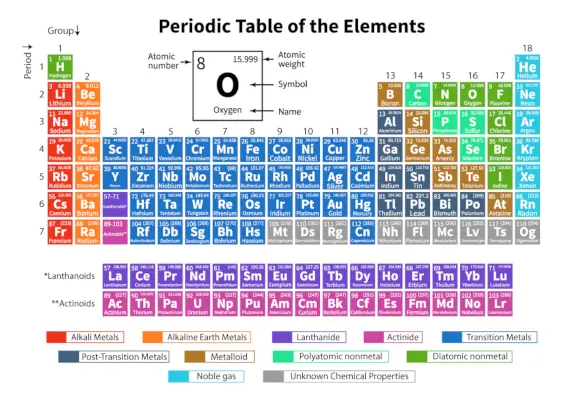
The Tabelul periodic de elemente este un aranjament sistematic de 118 elemente chimice cunoscute. Aceste elemente chimice sunt organizate în ordinea creșterii numărului atomic. Rândurile orizontale de la stânga la dreapta sunt numite perioade, în timp ce coloanele verticale de sus în jos sunt numite grupuri într-un tabel periodic.
Cuprins
- Ce este Tabelul Periodic?
- Lista elementelor tabelului periodic
- Termeni importanți în tabelul periodic
- Clasificarea elementelor în tabelul periodic
- Tabelul periodic al lui Mendeleev
- Întrebări frecvente despre Tabelul periodic al elementelor
Ce este Tabelul Periodic?
Un tabel periodic este o reprezentare tabelară în care toate elementele chimice cunoscute sunt aranjate în rânduri orizontale numite perioade și coloane verticale numite grupuri pe baza lor. numar atomic respectiv structura atomică.
Este un aranjament al tuturor elementelor cunoscute și, prin urmare, oferă informații despre elemente, cum ar fi masa lor, numărul de electroni, configurația electronică și proprietățile lor chimice unice.
Lista elementelor tabelului periodic
Iată tabelul reprezentând 118 elemente ale tabelului periodic. Elementele enumerate sunt aranjate în ordinea crescătoare a numărului atomic și în funcție de greutatea atomică, simbolul, densitatea și electronegativitatea lor.
| Elemente din tabelul periodic cu masa atomică | |||||
|---|---|---|---|---|---|
| Numar atomic | Numele elementului chimic | Simbol | Masa atomică (amu) | Densitate (g/cm 3 ) | Electronegativitatea |
| 1 | Hidrogen | H | 1,0079 | 0,00008988 | 2.2 |
| 2 | Heliu | El | 4,0026 | 0,0001785 | – |
| 3 | Litiu | Acea | 6.941 | 0,534 | 0,98 |
| 4 | Beriliu | Fi | 9,0122 | 1,85 | 1,57 |
| 5 | Bor | B | 10.811 | 2.34 | 2.04 |
| 6 | Carbon | C | 12.0107 | 2.267 | 2,55 |
| 7 | Azot | N | 14,0067 | 0,0012506 | 3.04 |
| 8 | Oxigen | O | 15,9994 | 0,001429 | 3.44 |
| 9 | Fluor | F | 18,9984 | 0,001696 | 3,98 |
| 10 | Neon | da | 20.1797 | 0,0009002 | – |
| unsprezece | Sodiu | Deja | 22,9897 | 0,968 | 0,93 |
| 12 | Magneziu | Mg | 24.305 | 1.738 | 1.31 |
| 13 | Aluminiu | La | 26,9815 | 2.7 | 1,61 |
| 14 | Siliciu | Da | 28,0855 | 2.329 | 1.9 |
| cincisprezece | Fosfor | P | 30,9738 | 1.823 | 2.19 |
| 16 | Sulf | S | 32.065 | 2.07 | 2,58 |
| 17 | Clor | Cl | 35.453 | 0,0032 | 3.16 |
| 18 | Argon | Cu | 39.948 | 0,001784 | – |
| 19 | Potasiu | K | 39,0983 | 0,89 | 0,82 |
| douăzeci | Calciu | Ca | 40.078 | 1,55 | 1 |
| douăzeci și unu | Scandiul | Sc | 44,9559 | 2.985 | 1.36 |
| 22 | Titan | De | 47.867 | 4.506 | 1,54 |
| 23 | Vanadiu | ÎN | 50,9415 | 6.11 | 1,63 |
| 24 | Crom | Cr | 51,9961 | 7.15 | 1,66 |
| 25 | Mangan | Mn | 54.938 | 7.21 | 1,55 |
| 26 | Fier | Credinţă | 55.845 | 7.874 | 1,83 |
| 27 | Cobalt | Co | 58,9332 | 8.9 | 1,88 |
| 28 | Nichel | În | 58,6934 | 8.908 | 1,91 |
| 29 | Cupru | Cu | 63.546 | 1.9 | 60 |
| 30 | Zinc | Zn | 65,39 | 1,65 | 70 |
| 31 | Galiu | Aici | 69.723 | 1,81 | 19 |
| 32 | germaniu | GE | 72,64 | 2.01 | 1.5 |
| 33 | Arsenic | La fel de | 74,9216 | 2.18 | 1.8 |
| 3. 4 | Seleniu | EL | 78,96 | 2,55 | 0,05 |
| 35 | Brom | Br | 79.904 | 2,96 | 2.4 |
| 36 | Krypton | NOK | 83.798 | 3 | 1×10−4 |
| 37 | Rubidiu | Rb | 85,4678 | 0,82 | 90 |
| 38 | Stronţiu | Sr | 87,62 | 0,95 | 370 |
| 39 | ytriu | ȘI | 88.906 | 1.22 | 33 |
| 40 | zirconiu | Zr | 91.224 | 1.33 | 165 |
| 41 | Niobiu | Nb | 92.906 | 1.6 | douăzeci |
| 42 | Molibden | lu | 95,94 | 2.16 | 1.2 |
| 43 | Tehnețiu | Tc | 98 | 1.9 | ~ 3×10−9 |
| 44 | Ruteniu | Ru | 101.07 | 2.2 | 0,001 |
| Patru cinci | Rodiu | Rh | 102,91 | 2.28 | 0,001 |
| 46 | Paladiu | Pd | 106,42 | 2.2 | 0,015 |
| 47 | Argint | La | 107,87 | 1,93 | 0,075 |
| 48 | Cadmiu | CD | 112.411 | 1,69 | 0,159 |
| 49 | Indiu | În | 114,82 | 1,78 | 0,25 |
| cincizeci | Crede | Sn | 118,71 | 1,96 | 23 |
| 51 | Antimoniu | Sb | 121,76 | 2.05 | 0,2 |
| 52 | Telurul | The | 127,6 | 2.1 | 0,001 |
| 53 | Iod | eu | 126,9045 | 2,66 | 0,45 |
| 54 | Xenon | Mașină | 131.293 | 2.6 | 3×10−5 |
| 55 | cesiu | Cs | 132,91 | 0,79 | 3 |
| 56 | Bariu | Nu | 137.327 | 0,89 | 425 |
| 57 | Lantan | The | 138,91 | 1.1 | 39 |
| 58 | ceriu | Acest | 140,12 | 1.12 | 66,5 |
| 59 | Praseodimiu | Relatii cu publicul | 140,9077 | 1.13 | 9.2 |
| 60 | Neodim | Nd | 144,24 | 1.14 | 41,5 |
| 61 | Prometiu | P.m | 145 | 1.13 | 2×10−19 |
| 62 | Samariul | Sm | 150,36 | 1.17 | 7.05 |
| 63 | Europiu | UE | 151.964 | 1.2 | 2 |
| 64 | Gadoliniu | Gd | 157,25 | 1.2 | 6.2 |
| 65 | terbiu | Tb | 158,9253 | 1.2 | 1.2 |
| 66 | Disprosiu | Acestea | 162,5 | 1.22 | 5.2 |
| 67 | Holmiu | La | 164,9303 | 1.23 | 1.3 |
| 68 | Erbiu | Este | 167.259 | 1.24 | 3.5 |
| 69 | Tuliu | Tm | 168,9342 | 1.25 | 0,52 |
| 70 | Iterbiu | Yb | 173.04 | 1.1 | 3.2 |
| 71 | Paris | lu | 174.967 | 1.27 | 0,8 |
| 72 | hafniu | Hf | 178,49 | 1.3 | 3 |
| 73 | Tantal | Confruntare | 180,9479 | 1.5 | 2 |
| 74 | Tungsten | ÎN | 183,84 | 2.36 | 1.3 |
| 75 | reniu | Re | 186.207 | 1.9 | 7×10−4 |
| 76 | Osmiu | Tu | 190,23 | 2.2 | 0,002 |
| 77 | Iridiu | Și | 192,22 | 2.2 | 0,001 |
| 78 | Platină | Pt | 195.08 | 2.28 | 0,005 |
| 79 | Aur | La | 196,97 | 2,54 | 0,004 |
| 80 | Mercur | Hg | 200,59 | 2 | 0,085 |
| 81 | Taliu | Tl | 204,3833 | 1,62 | 0,85 |
| 82 | Conduce | Pb | 207,2 | 1,87 (2+) 2,33 (4+) | 14 |
| 83 | Bismut | Cu | 208,9804 | 2.02 | 0,009 |
| 84 | Poloniu | După | 209 | 2 | 2×10−10 |
| 85 | Astatin | La | 210 | 2.2 | 3×10−20 |
| 86 | Radon | Rn | 222 | 2.2 | 4×10−13 |
| 87 | Franciu | pr | 223 | >0,79[6] | ~ 1×10−18 |
| 88 | Radiu | Soare | 226 | 0,9 | 9×10−7 |
| 89 | actiniu | Și | 227 | 1.1 | 5,5×10−10 |
| 90 | Toriu | Th | 232,0381 | 1.3 | 9.6 |
| 91 | Protactiniu | Bine | 231,0359 | 1.5 | 1,4×10−6 |
| 92 | Uraniu | ÎN | 238,0289 | 1,38 | 2.7 |
| 93 | Neptun | De exemplu | 237 | 1.36 | ≤ 3×10−12 |
| 94 | Plutoniu | Ar putea | 244 | 1.28 | ≤ 3×10−11 |
| 95 | Americiu | A.m | 243 | 1.13 | – |
| 96 | Curium | Cm | 247 | 1.28 | – |
| 97 | Berkeliu | Bk | 247 | 1.3 | – |
| 98 | California | Cf | 251 | 1.3 | – |
| 99 | Einsteiniu | Este | 252 | 1.3 | – |
| 100 | Fermium | Fm | 257 | 1.3 | – |
| 101 | Mendeleev | Md | 258 | 1.3 | – |
| 102 | Nobil | Nu | 259 | 1.3 | – |
| 103 | Lawrence | Lr | 262 | 1.3 | – |
| 104 | Rutherfordium | Rf | 267 | – | – |
| 105 | Dubnium | Db | 268 | – | – |
| 106 | Seaborgium | Sg | 269 | – | – |
| 107 | Bohrium | Bh | 270 | – | – |
| 108 | Hassium | Hs | 269 | – | – |
| 109 | Meitnerium | Mt | 277 | – | – |
| 110 | Darmstadtium | Ds | 281 | – | – |
| 111 | Roentgeniu | Rg | 282 | – | – |
| 112 | Copernic | Cn | 285 | – | – |
| 113 | Nihonium | Nh | 286 | – | – |
| 114 | Flerovium | În | 290 | – | – |
| 115 | Moscovia | Mc | 290 | – | – |
| 116 | Livermorium | Lv | 293 | – | – |
| 117 | Tennessine | Ts | 294 | – | – |
| 118 | Oganesson | Și | 294 | – | – |
Termeni importanți în tabelul periodic
| Termeni câini de raft | Descriere |
|---|---|
| Numar atomic | Numărul de protoni care constituie nucleul unui element se numește numărul său atomic (Z). de exemplu. Carbonul conține atunci 6 protoni, așa că numărul său atomic trebuie să fie doar 6. |
| Masă atomică | Este definit ca masa medie a atomilor unui element. Se măsoară pe baza abundenței relative naturale a izotopilor elementului. Masă atomică mai este denumită și Greutate Atomică (A). Se măsoară în unitatea de masă atomică (amu). |
| Perioadă | Rândurile orizontale de la stânga la dreapta dintr-un tabel periodic se numesc perioade. În tabelul periodic există un total de 7 perioade. Elementele sunt aranjate orizontal datorită asemănărilor lor în proprietăți, ca aceiași orbitali atomici și așa mai departe. |
| grup | Coloanele verticale de sus în jos într-un tabel periodic se numesc Grupuri. Există un total de 18 grupuri în tabelul periodic. Elementele sunt dispuse vertical datorită asemănărilor lor în proprietăți, deoarece au același număr de electroni de valență în ele. |
| Simbol al unui element | Un simbol este o noțiune care este folosită pentru a reprezenta un element chimic folosind o literă sau o combinație de două până la trei litere. de exemplu. Simbolul chimic al carbonului este C, în timp ce Fe este folosit pentru fier și așa mai departe. |
Clasificarea elementelor în tabelul periodic
Cele 118 elemente sunt aranjate în 7 perioade și 18 grupuri, așa cum se arată mai sus. În plus, elementele sunt împărțite în diferite blocuri.
| bloc | Elemente incluse | Ultimul subshell de electroni umplut |
|---|---|---|
| s-bloc | Grupa 1 (metale alcaline) | s-subshell |
| Grupa 2 (Metale alcalino-pământoase) | ||
| p-bloc | Grupa 13 (Familia Boron) | p-subshell |
| Grupa 14 (Familia Carbon) | ||
| Grupa 15 (Familia azotului) | ||
| Grupa 16 (Familia oxigenului) | ||
| Grupa 17 (Familia Fluor) | ||
| d-bloc | Grupurile de la 3 la 12 (Elemente de tranziție) | d-subshell |
| f-bloc | Lantanide (elementele pământului rare) | f-subshell |
| Actinide |
Tabelul periodic al lui Mendeleev
Pentru a reprezenta asemănările și tendințele în comportamentul elementelor, Mendeleev a dezvoltat tabelul periodic, care este o aranjare a elementelor într-o ordine crescătoare a masei atomice în formă tabelară.

Conform Tabelului periodic al lui Mendeleev, elementele au fost aranjate în funcție de proprietatea lor fundamentală, masa atomică și caracteristicile chimice. Numai 63 de elemente erau cunoscute la momentul lucrării lui Mendeleev. În tabelul periodic Mendeleev, rândul orizontal și coloanele verticale au fost denumite grupuri și, respectiv, perioade.
Cu toate acestea, Tabelul periodic al lui Mendeleev eșuează din cauza multor defecte ale acestuia. Unele dintre ele sunt că nu a reușit să desemneze hidrogenul și gazele nobile în el. De asemenea, ordinea crescătoare a masei atomice a elementelor nu a fost obișnuită pe tot parcursul tabelului. Chiar și descoperirea izotopilor încalcă Legea periodică Mendeleev.
Citeşte mai mult:
- Tabelul periodic modern
- Tabelul periodic al lui Mendeleev
- Dreptul periodic modern
- Istoria tabelului periodic
- Structura atomica
Întrebări frecvente despre Tabelul periodic al elementelor
Ce este Tabelul Periodic al Elementelor?
Tabelul periodic al elementelor este un aranjament tabelar al elementelor chimice organizate după numărul lor atomic, configurația electronică și proprietățile chimice recurente. Tabelul este împărțit în rânduri numite perioade și coloane numite grupuri sau familii.
Cine a descoperit Tabelul Periodic al Elementelor?
Tabelul periodic al elementelor nu a fost descoperit de o singură persoană, dar dezvoltarea lui este creditată lui Dmitri Mendeleev, un chimist rus, care a aranjat elementele pe baza proprietăților lor în 1869.
Cine a realizat Tabelul Periodic Modern?
În 1913, Henry Moseley a introdus o versiune actualizată a tabelului periodic, denumit în mod obișnuit Tabelul periodic modern.
Cum este aranjat tabelul periodic?
Tabelul periodic este aranjat în ordinea creșterii numărului atomic, cu elemente grupate pe baza proprietăților chimice similare și aranjate în perioade (rânduri) și grupuri (coloane).
Ce este numărul atomic?
Numărul de protoni care constituie nucleul unui element se numește numărul său atomic (Z). de exemplu. Carbonul conține 6 protoni atunci, numărul său atomic trebuie să fie doar 6.
Două elemente diferite pot avea același număr atomic?
Numărul de neutroni dintr-un atom din două elemente diferite poate fi similar, dar numărul de protoni nu va fi niciodată același. Fiecare element are un anumit număr de protoni, care corespunde numărului de atomi.
Cum se calculează masa atomică?
Masa atomică poate fi calculată prin adăugarea masei protonilor și neutronilor dintr-un element.
Ce este un grup în tabelul periodic?
Coloana din tabelul periodic se referă la grupul din tabelul periodic. Elementele aceluiași grup au proprietăți fizice și chimice similare.
