Principiul Aufbau este metoda de bază care ne spune cum sunt umpluți electronii în orbital atomic. Conform principiului Aufbau, umplerea electronilor în starea fundamentală a unui atom urmează un model de bază. Acest principiu ne spune că electronii din orbital atomic al oricăror atomi sunt umpluți în ordinea crescătoare a energiei lor și pentru a afla energia orbitalului atomic ei urmează regula n+l.
Principiul structurii
În acest articol, vom afla despre Principiul Aufbau, Caracteristicile Principiului Aufbau, excepțiile și limitările sale în detaliu.
awt java
Definirea principiului structurii
Principiul lui Aufbau spune că
Electronii din diferiți orbitali sunt umpluți în ordinea crescătoare a energiei lor, adică orbitalul cu cea mai mică energie va fi umplut primul și orbitalul cu cea mai mare energie va fi umplut ultimul.
Cuvântul „Aufbau” în germană înseamnă „construire”. Formarea orbitalilor înseamnă umplerea orbitalilor cu electroni. Afirmă că electronii din orbitalii atomici sunt umpluți în ordinea crescătoare a energiei orbitalului atomic. Iar energia orbitalului atomic se calculează folosind regula n+l care spune dacă electronul cu un număr mai mare de valoarea n+l are energia mai mare. În regula discutată în rândul precedent, n spune numărul cuantic principal și l spune numărul cuantic azimutal.
Dacă doi electroni au aceeași valoare de n+l atunci electronul cu o valoare mai mică de n are energia mai mică și este umplut primul. Ordinea de umplere a electronilor într-un orbital atomic este discutată mai jos.
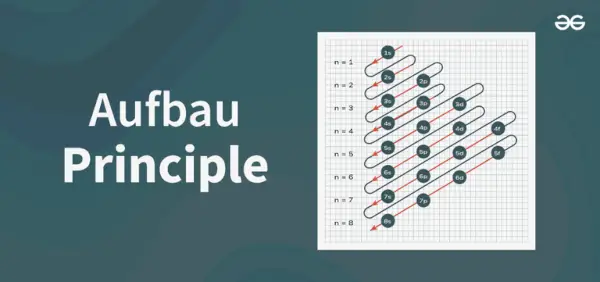
Structura diagramei de principiu
Diagrama principiului Aufbau este diagrama care ilustrează ordinea de umplere a electronilor dintr-un atom.
Structura diagramei de principiu
Structura formulei de principiu
Formula principiului Aufbau este formula care spune ordinea în care electronii sunt umpluți în orbital atomic. Formula orbital atomic este
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p…….
Structura principiului Clasa 11
Principiul Aufbau este un principiu important al Chimiei pentru elevii din clasa 11. Acest principiu prevede că,
Electronii din orbital atomic al unui atom sunt umpluți în ordinea crescătoare a energiei orbitalului atomic care se calculează folosind regula (n+l).
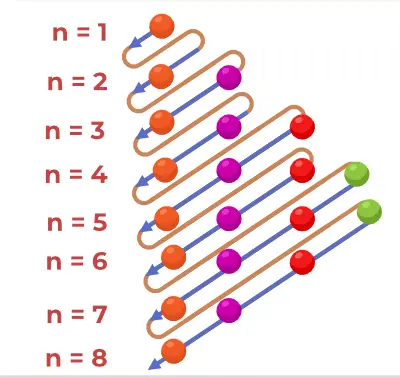
Desenarea diagramei structurii
Diagrama Aufbau este desenată folosind pașii adăugați mai jos,
- Aflați numărul de electroni care urmează să fie umpluți în atomi.
- Știm că într-un atom
- orbitalul s poate deține maxim 2 electroni.
- orbitalul p poate conține maximum 6 electroni.
- orbitalul d poate conține maximum 10 electroni.
- orbitalul f poate conține maximum 14 electroni.
- Completați primii doi electroni din orbitalul 1s.
- Apoi urmați regula n+l și apoi umpleți electronii în consecință.
Caracteristicile esențiale ale principiului structurii
Diverse caracteristici ale principiului Aufbau sunt:
- Energia unui orbital depinde de suma valorilor numărului cuantic principal (n) și a numărului sumă azimutală (I). Aceasta se numește (n + l) regulă . Conform acestei reguli,
- Într-un atom neutru izolat, cu cât valoarea lui (n + l) pentru un orbital este mai mică, cu atât energia acestuia este mai mică. Totuși, dacă două tipuri diferite de orbitali au aceeași valoare (n + l), atunci orbitalii cu o valoare mai mică de n au mai puțină energie.
| Tip de orbital | Valoarea lui n | Valoarea de l | Valoarea lui n+l | Energie relativă |
|---|---|---|---|---|
| 1s | 1 | 0 | 1+0 = 1 | Cea mai scăzută energie |
| 2s | 2 | 0 | 2+0 = 2 când a ieșit câștigul 7 | Energie mai mare decât orbitalul 1s |
| 2p 3s | 2 3 | 1 0 java system.out.println | 2+1 = 3 3+0 = 3 | Orbitalii 2p(n=2) au o energie mai mică decât orbitalul 3s(n=3). |
| 3p 4s | 3 4 | 1 0 | 3+1 = 4 4+0 = 4 | Orbitalii 3p(n=3) au o energie mai mică decât orbitalii 4s(n=4). |
| 3d 4p | 3 4 | 2 alăturare stânga vs alăturare dreapta 1 | 3+2 = 5 4+1 = 5 | Orbitalii 3d(n=3) au o energie mai mică decât orbitalii 4p(n=4). |
Din descrierea dată în tabel, rezultă că energiile diferiților orbitali cresc odată cu creșterea numărului numărului cuantic principal.
- Astfel, ordinea în care electronii sunt umpluți în orbital atomic al atom este, 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p...
Configurație electronică folosind principiul Aufbau
The configuratie electronica utilizarea Principiului Aufbau pentru câteva elemente este discutată mai jos:
Configurația electronică a sulfului
Numar atomic de sulf este 16, adică are 16 electroni
Acum, folosind principiul Aufbau, configurația electronică a sulfului este scrisă ca:
[S] = 1s 2 2s 2 2p 6 3s 2 3p 4
Configurația electronică a azotului
Numărul atomic al azotului este 7, adică are 7 electroni
Acum, folosind principiul Aufbau, configurația electronică a azotului este scrisă ca:
[N] = 1s 2 2s 2 2p 3
Excepții de la principiul construcției
Există câteva excepții de la principiul Aufbau, care sunt cromul și cuprul. Configurația lor electronică este,
Configurația electronică a cromului
Configurația electronică a Chromium conform principiului Aufbau ar trebui să fie
- Cr(24): [Ar]3d 4 4s 2
Dar configurația de mai sus nu este corectă, deoarece configurația electronică reală a Chromium(Cr) este,
- Cr(24): [Ar]3d 5 4s 1
Motivul acestei configurații electronice este că orbital d-atomic plin pe jumătate este mai stabil decât orbitalul umplut conform principiului Aufbau.
misiune imposibilă toate filmele
Configurația electronică a cuprului
Configurația electronică a cuprului conform principiului Aufbau ar trebui să fie,
- Cu(29): [Ar]3d 9 4s 2
Configurația de mai sus nu este corectă deoarece configurația electronică reală a Cupru (Cu) este,
- Cu(29): [Ar]3d 10 4s 1
Motivul acestei configurații electronice este că orbital d-atomic plin este mai stabil decât orbitalul umplut conform principiului Aufbau.
Citeşte mai mult
- Numerele cuantice
- Forma orbitalilor atomici
- Structura atomica
Principiul structurii – Întrebări frecvente
Ce este principiul Aufbau în chimie?
Principiul Aufbau în chimie este principiul de bază care este folosit pentru a umple electronii din orbitalii atomici ai oricărui atom. Această teoremă ne spune ordinea în care electronii sunt umpluți în orbital atomic.
Cine a dat principiul lui Aufbau?
Principiul Aufbau a fost dat de celebrul fizician danez Niels Bohr în 1920.
Care este principiul excluderii lui Pauli?
Principiul de excludere al lui Pauli afirmă că într-un atom nu există doi electroni să aibă toate cele patru numere cuantice t el la fel. Cel puțin, unul dintre numărul cuantic este diferit pentru toți electronii din atom.
Ce este regula n+l?
Regula n+l este regula care spune că energia unui orbital depinde de suma numărului cuantic principal (n) și a numărului cuantic azimutal (l). această regulă se numește regula (n+l).
Care sunt excepțiile de la principiul Aufbau?
Excepția de la principiul Aufbau sunt:
- Configurația electronică a cromului Cr[24]
- Configurația electronică a cuprului Cu[29]
